Задание 33. Установление молекулярной и структурной формулы вещества. ЕГЭ 2026 по химии
Средний процент выполнения: 30.2%
Ответом к заданию 33 по химии может быть развернутый ответ (полная запись решения с обоснованием выполненных действий).
Подпишись на суперполезные материалы

Задачи для практики
Задача 1
В результате сплавления органического вещества с гидроксидом калия был получен углеводород, 1,17 г паров которого занимают объём 336 мл (н. у.). Известно, что исходное вещество относится к классу солей. В этом соединении число атомов кислорода равно числу атомов водорода.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с гидроксидом калия при сплавлении (используйте структурные формулы органических веществ).
Решение
1) Находим молярную массу углеводорода.
Пусть формула полученного углеводорода $C_xH_y$.
$n = V_г$ / $V_M$; $n(C_xH_y)$ = 0.336 / 22.4 = 0.015 моль
$M(C_xH_y) = m_{в-ва}$ / n = 1.17 / 0.015 = 78 г/моль
2) Находим молекулярную формулу углеводорода:
12x + y = 78
если x = 6, y = 6
Формула углеводорода — $C_6H_6$, молекулярная формула исходного вещества $C_8H_4O_4K_2$.
3) Составляем структурную формулу соли:
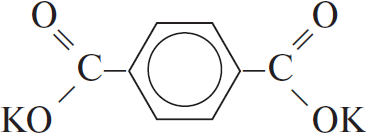
4) Уравнение реакции:
$KOOC–C_6H_4–COOK + 2KOH → 2K_2CO_3 + C_6H_6$
Задача 2
При сгорании 11,6 г органического вещества выделилось 13,44 л (н. у.) углекислого газа и 10,8 мл воды. Плотность паров этого вещества равна 2,59 г/л. Вещество реагирует с гидроксидом меди(II).
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с свежеосажденным гидроксидом меди(II) (используйте структурные формулы органических веществ).
Решение
Пусть формула вещества — $C_xH_yO_z$.
1) Находим количественный состав образца:
а) n(C) = n($CO_2$) = 13.44 / 22.4 = 0.6 моль
m(C) = 0.6 · 12 = 7.2 г
б) m($H_2O$) = 1 · 10.8 = 10.8 г; n(H) = 2n($H_2O$) = 2 · 10.8 / 18 = 1.2 моль
m(H) = 1 · 1.2 = 1.2 г
в) m(O) = 11.6 – 7.2 – 1.2 = 3.2 г; n(O) = 3.2 / 16 = 0.2 моль
2) Находим молекулярную формулу вещества:
а) x : y : z = n(C) : n(H) : n(O) = 0.6 : 1.2 : 0.2 = 3 : 6 : 1
Вычисленная формула — $C_3H_6O$.
M($C_3H_6O$) = 12 · 3 + 6 + 16 = 58 г/моль
б) M($C_xH_yO_z$) = 2.59 · 22.4 / 1 = 58,016 ≈ 58 г/моль
в) M($C_xH_yO_z$) / M($C_3H_6O$) = 58 : 58 = 1
Молекулярная формула — $C_3H_6O$.
3) Структурная формула вещества — $CH_3–CH_2–CHO$
4) Составляем уравнение реакции окисления пропаналя:
$CH_3–CH_2CHO + 2Cu(OH)_2 → CH_3–CH_2–COOH + Cu_2O + 2H_2O$
Задача 3
Вещество, которое содержит 61,54 % кислорода, 34,62 % углерода и 3,84 % водорода по массе, было получено при взаимодействии углеводорода состава $С_5H_8$ с раствором перманганата калия в присутствии серной кислоты.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного углеводорода с подкисленным раствором перманганата калия (используйте структурные формулы органических веществ).
Решение
Пусть формула вещества — $C_xH_yO_z$.
1) Находим количественный состав вещества.
Пусть $m_{в-ва}$ = 100 г, тогда:
а) m(C) = 34.62 г, n(C) = 34.62 / 12 ≈ 2.89 моль
б) m(H) = 3.84 г, n(H) = 3.84 / 1 = 3.84 моль
в) m(O) = 61.54 г, n(O) = 61.54 / 16 ≈ 3.85 моль
2) Находим молекулярную формулу вещества:
x : y : z = n(C) : n(H) : n(O) = 2.89 : 3.84 : 3.85 ≈ 1 : 1.33 : 1. 33 ≈ 3 : 4 : 4.
Молекулярная формула — $C_3H_4O_4$.
3) Структурная формула — 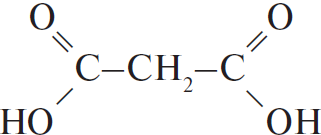
4) Уравнение реакции окисления углеводорода:
$CH_2=CH–CH_2–CH=CH_2 + 4KMnO_4 + 6H_2SO_4 → 2K_2SO_4 + 4MnSO_4 + 8H_2O + 2CO_2 +$ 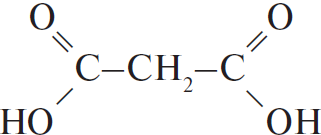
Задача 4
При сгорании 3 г жидкого (н. у.) органического вещества получили 5,04 л углекислого газа (н. у.) и 2,7 г воды. Известно, что при окислении этого вещества сернокислым раствором перманганата калия образуется одноосновная кислота и выделяется углекислый газ.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции окисления исходного вещества раствором перманганата калия в кислой среде (используйте структурные формулы органических веществ).
Решение
Пусть формула вещества — $C_xH_yO_z$.
1) Находим количественный состав образца:
n(C) = n($CO_2$) = 5.04 / 22.4 = 0.225 моль
m(C) = 0.225 · 12 = 2.7 г
n(H) = 2n($H_2O$) = 2 · 2.7 / 18 = 0.3 моль
m(H) = 0.3 · 1 = 0.3 г
m(O) = 3 – (2.7 + 0.3) = 0 г, кислорода в веществе нет
2) Находим вычисленную формулу:
x : y = n(C) : n(H) = 0.225 : 0.3 = 2.25 : 3 = 4.5 : 6 = 9 : 12
Вычисленная формула — $C_9H_{12}$.
3) Структурная формула вещества — 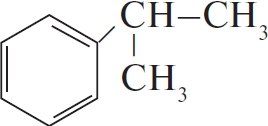
4) Уравнение реакции окисления:  $+ 18KMnO_4 + 27H_2SO_4 → 18MnSO_4 + 9K_2SO_4 + 42H_2O + 10CO_2 +$
$+ 18KMnO_4 + 27H_2SO_4 → 18MnSO_4 + 9K_2SO_4 + 42H_2O + 10CO_2 +$ 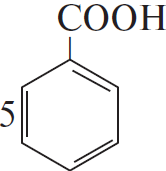
или
$5C_6H_5CH(CH_3)_2 + 18KMnO_4 + 27H_2SO_4 → 5C_6H_5COOH + 10CO_2 + 18MnSO_4 + 9K_2SO_4 + 42H_2O$
Задача 5
При взаимодействии 3,6 г органического вещества с избытком гидроксида меди(II) при нагревании образовался осадок красного цвета массой 14,4 г.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с гидроксидом меди(II).
Решение
Осадок красного цвета образуется при нагревании $Cu(OH)_2$ с альдегидами.
Пусть формула вещества — RCHO.
1) Уравнение реакции в общем виде:
$RCHO + 2Cu(OH)_2 → RCOOH + Cu_2O + 2H_2O$
2) Находим молярную массу альдегида:
а) рассчитываем количество вещества $Cu_2O$:
M($Cu_2O$) = 144 г/моль, n($Cu_2O$) = 14.4 / 144 = 0.1 моль
б) по уравнению реакции:
n(RCHO) = n($Cu_2O$) = 0.1 моль
M(RCHO) = 3.6 / 0.1 = 36 г/моль
3) Находим молекулярную формулу вещества:
M(RCHO) = (M(R) + 29) г/моль
M(R) + 29 = 36
M(R) = 7 — решения нет, следовательно, в молекуле вещества не одна группа CHO, а несколько.
Пусть формула вещества — $R(CHO)_2$, тогда:
$R(CHO)_2 + 4Cu(OH)_2 → R(COOH)_2 + 2Cu_2O + 4H_2O$
$n(R(CHO)_2) = 0.5n(Cu_2O)$ = 1 ∙ 0.1 / 2 = 0.05 моль
$M(R(CHO)_2)$ = 3.6 / 0.05 = 72 г/моль
M(R) + (12 + 1 + 16) ∙ 2 = 72
M(R) = 14
$M(C_xH_y)$ = 14, x = 1, y = 2, формула радикала $CH_2$
Молекулярная формула вещества — $CH_2(CHO)_2$, т. е. $C_3H_4O_2$
Структурная формула — $OHC–CH_2–CHO$
Уравнение реакции:
$OHC–CH_2–CHO + 4Cu(OH)_2 → HOOC–CH_2–COOH + 2Cu_2O + 4H_2O$
Задача 6
При сгорании 2,7 г органического вещества получили 3,92 л (н. у.) углекислого газа и 1,8 г воды. Известно, что вещество реагирует с раствором гидроксида натрия, а в реакции с бромной водой образуется трибромпроизводное этого вещества.
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с водным раствором брома (используйте структурные формулы органических веществ).
Решение
Пусть формула вещества — $C_xH_yO_z$.
Так как вещество реагирует с раствором щёлочи, то оно проявляет кислотные свойства. Так как вещество при взаимодействии с бромной водой образует трибромпроизводное, то оно может относиться к классу фенолов.
1) Находим количественный состав образца:
М(C) = 12 г/моль; М(H) = 1 г/моль; М(O) = 16 г/моль,
M($H_2O$) = 18 г/моль; $V_M$ = 22.4 л/моль
а) n(C) = n($CO_2$) = 3.92 / 22.4 = 0.175 моль
m(C) = 0.175 · 12 = 2.1 г
б) n(H) = 2n($H_2O$) = 2 · 1.8 / 18 = 0.2 моль
m(H) = 1 · 0.2 = 0.2 г
в) m(O) = 2.7 – 2.1 – 0.2 = 0.4 г; n(O) = 0.4 / 16 = 0.025 моль
2) Находим молекулярную формулу вещества:
x : y : z = n(C) : n(H) : n(O) = 0.175 : 0.2 : 0.025 = 7 : 8 : 1.
Молекулярная формула — $C_7H_8O$.
3) Структурная формула — 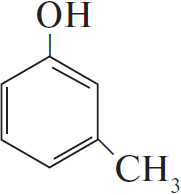
4) Уравнение взаимодействия м-крезола с бромной водой:  $+ 3Br_2 → 3HBr +$
$+ 3Br_2 → 3HBr +$ 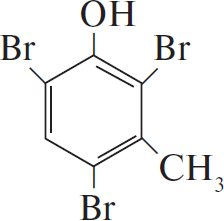
Задача 7
При сгорании 32,75 г органического вещества А получили 33,6 л углекислого газа (н. у.), 2,8 л азота (н. у.) и 29,25 г воды. Известно, что вещество А можно получить при взаимодействии природного вещества Б со спиртом, а при его нагревании с соляной кислотой образуется соединение состава $С_3H_8NО_2Cl$ и вторичный спирт.
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с раствором соляной кислоты при нагревании (используйте структурные формулы органических веществ).
Решение
Пусть формула вещества — $C_xH_yN_zO_w$, тогда:
1) m(C) = n($CO_2$) = 33.6 / 22.4 = 1.5 моль
m(C) = 1.5 · 12 = 18 г
n(H) = 2n($H_2O$) = 2 · 29.25 / 18 = 3.25 моль
m(H) = 3.25 · 1 = 3.25 г
n(N) = 2n($N_2$) = 2 · 2.8 / 22.4 = 0.25 моль
m(N) = 0.25 · 14 = 3.5 г
m(O) = 32.75 – (18 + 3.25 + 3.5) = 8 г
n(O) = 8 / 16 = 0.5 моль
2) x : y : z : w = n(C) : n(H) : n(N) : n(O) = 1.5 : 3.25 : 0.25 : 0.5 = 6 : 13 : 1 : 2
Вычисленная формула — $C_6H_{13}NO_2$.
3) Структурная формула вещества — 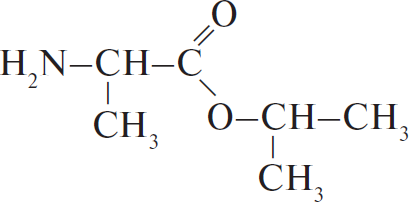
4)  $+ HCl + H_2O →$
$+ HCl + H_2O →$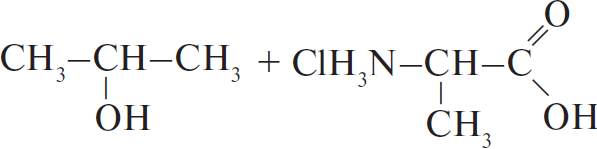
Задача 8
При полном сгорании углеводорода образовалось 8,96 л (н. у.) диоксида углерода и 5,4 г воды. Молярная масса углеводорода в 27 раз больше молярной массы водорода. При исследовании химических свойств этого вещества установлено, что оно обесцвечивает бромную воду, присоединяя атомы брома по четырем разным атомам углерода.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с недостатком бромной воды (используйте структурные формулы органических веществ).
Решение
1) Находим количественный состав вещества.
Формула вещества — $C_xH_y$.
а) n(C) = n($CO_2$) = 8.96 / 22.4 = 0.4 моль
б) n(H) = 2n($H_2O$) = 2 · 5.4 / 18 = 0.6 моль
2) Определяем молекулярную формулу вещества:
а) $M_{ист.}(C_xH_y) = D(по H_2) · M(H_2)$ = 27 · 2 = 54 г/моль
б) x : y = n(C) : n(H) = 0.4 : 0.6 = 2 : 3 = 4 : 6
Вычисленная формула — $C_4H_6$.
$M_{выч.}(C_4H_6)$ = 54 г/моль
в) $M_{ист.}(C_xH_y)$ / $M_{выч.}(C_4H_6)$ = 54 / 54 = 1
Молекулярная формула исходного вещества — $C_4H_6$.
3) Структурная формула вещества — $CH_2=CH–CH=CH_2$ — бутадиен-1,3.
4) Записываем уравнение реакции вещества с бромом:
$CH_2=CH–CH=CH_2 + Br_2 → CH_2Br–CH=CH–CH_2Br$
Задача 9
При сгорании монобромпроизводного органического вещества массой 6,15 г образовался углекислый газ, 2,7 мл воды и бромоводород объёмом 1,12 л (н. у.). Известно, что данное вещество было получено при взаимодействии органического вещества с бромом при освещении.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу монобромпроизводного органического вещества;
- составьте структурную формулу этого органического вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции этого вещества с водным раствором гидроксида натрия (используйте структурные формулы органических веществ).
Решение
Допустим, что в веществе не содержится кислород, т. е. формула — $C_xH_yBr$.
1) Находим количественный состав образца:
а) n(Br) = n(H) = n(HBr) = 1.12 / 22.4 = 0.05 моль
m(Br) = 0.05 · 80 = 4 г
б) m($H_2O$) = 2.7 · 1 = 2.7 г; n(H) = 2n($H_2O$) = 2 · 2.7 / 18 = 0.3 моль
$n(H)_{общее}$ = 0.05 + 0.3 = 0.35 моль
m(H) = 1 · 0.35 = 0.35 г
в) m(C) = 6.15 – (4 + 0.35) = 1.8 г; n(C) = 1.8 / 12 = 0.15 моль
2) Находим молекулярную формулу вещества:
а) $M(C_xH_yBr)$ = 6.15 / 0.05 = 123 г/моль
б) x : y : z = n(C) : n(H) : n(Br) = 0.15 : 0.35 : 0.05 = 3 : 7 : 1
Вычисленная формула — $C_3H_7Br$.
$M(C_3H_7Br)$ = 36 + 7 + 80 = 123 г/моль
$M(C_xH_yBr)$ / $M(C_3H_7Br)$ = 123 / 123 = 1
Формула галогенпроизводного — $C_3H_7Br$
3) Структурная формула — $CH_3–CH(Br)–CH_3$
4) Уравнение реакции вещества с водным раствором гидроксида натрия:
$CH_3–CHBr–CH_3 + NaOH → NaBr + CH_3–CH(OH)–CH_3$
Задача 10
Массовая доля водорода 3,41, углерода 34,09 %, кислорода 36,36 %, натрия 26,14 % в органическом веществе. Вещество реагирует с гидроксидом натрия с образованием углеводорода.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с гидроксидом натрия при сплавлении(используйте структурные формулы органических веществ).
Решение
1) Находим молекулярную формулу вещества.
Пусть формула вещества — $C_xH_yO_zNa_t$ и $m_{образца}$ = 100 г, тогда:
а) m(C) = 34.09 г, n(C) = 34.09 / 12 ≈ 2.84 моль
m(H) = 3.41 г, n(H) = 3.41 / 1 = 3.41 моль
m(O) = 36.36 г, n(O) = 36.36 / 16 = 2.27 моль
m(Na) = 26.14 г, n(Na) = 26.14 / 23 ≈ 1.14 моль
б) x : y : z : t = n(C) : n(H) : n(O) : n(Na) = 2.84 : 3.41 : 2.27 : 1.14 =
= (2.84/1.14) : (3.41/1.14) : (2.27/1.14) : (1.14/1.14) ≈
≈ 2.49 : 2,99 : 1,99 : 1 (умножаем на два) ≈ 4.98 : 5.98 : 3.98 : 2 ≈ 5 : 6 : 4 : 2
Молекулярная формула: $C_5H_6O_4Na_2$.
2) Структурная формула — $NaO–CO–CH_2–CH_2–CH_2–CO–ONa$ или
$NaO–CO–CH(CH_3)–CH_2–CO–ONa$
3) Уравнение реакции:
$NaO–CO–CH_2–CH_2–CH_2–CO–ONa + 2NaOH → 2Na_2CO_3 + CH_3–CH_2–CH_3$
или
$NaO–CO–CH(CH_3)–CH_2–CO–ONa + 2NaOH → 2Na_2CO_3 + CH_3–CH_2–CH_3$
Задача 11
При сгорании 1,8 г органического вещества, не содержащего кислорода, получили углекислый газ, 2,52 г воды и 448 мл (н. у.) азота. Известно, что вещество не может быть получено восстановлением соответствующего нитросоединения, но вступает в реакцию c хлорэтаном.
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу исходного вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного вещества с хлорэтаном (используйте структурные формулы органических веществ).
Решение
Формула вещества — $C_xH_yN_z$.
1) Количественный состав образца:
М(C) = 12 г/моль, М(H) = 1 г/моль, М(N) = 14 г/моль, M($H_2O$) = 18 г/моль
n(H) = 2n($H_2O$) = 2 · 2.52 / 18 = 0.28 моль; m(H) = 0.28 · 1 = 0.28 г
n(N) = 2n($N_2$) = 2 · 0.448 / 22.4 = 0.04 моль; m(N) = 0.04 · 14 = 0.56 г
m(C) = 1.8 – 0.28 – 0.56 = 0.96 г; n(C) = 0.96 / 12 = 0.08 моль
2) Вычисленная формула:
x : y : z = n(C) : n(H) : n(N) = 0.08 : 0.28 : 0.04 = 2 : 7 : 1
Вычисленная формула — $C_2H_7N$.
3) Структурная формула — $CH_3–NH–CH_3$
4) Уравнение реакции: $CH_3–NH–CH_3 + C_2H_5Cl → [(CH_3)_2NH(C_2H_5)]^{+}Cl^{–}$
Задача 12
Некоторое вещество было получено при окислении циклического углеводорода, не содержащего заместителей в цикле, перманганатом калия в присутствии серной кислоты. Это вещество содержит 40,68 % углерода, 54,24 % кислорода и 5,08 % водорода по массе.
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу полученного вещества;
- составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции исходного органического вещества с перманганатом калия в присутствии серной кислоты (используйте структурные формулы органических веществ).
Решение
Формула вещества — $C_xH_yO_z$.
1) Находим количественный состав образца.
Пусть $m_{в-ва}$ = 100 г, тогда
m(C) = 40.68 г; n(C) = 40.68 / 12 = 3.39 моль
m(H) = 5.08 г; n(H) = 5.08 / 1 = 5.08 моль
m(O) = 54.24 г; n(O) = 54.24 / 16 = 3.39 моль
2) Находим молекулярную формулу:
x : y : z = n(C) : n(H) : n(O) =
= 3.39 : 5.08 : 3.39 =
= 1 : 1.5 : 1 = (умножаем на 2)
= 2 : 3 : 2 = (умножаем на 2)
= 4 : 6 : 4
Вычисленная формула — $C_4H_6O_4$.
3) Структурная формула вещества — 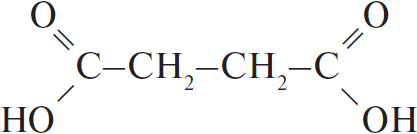
4) Уравнение реакции окисления циклического углеводорода:
5  $+ 8KMnO_4 + 12H_2SO_4 → 4K_2SO_4 + 8MnSO_4 + 12H_2O + 5$
$+ 8KMnO_4 + 12H_2SO_4 → 4K_2SO_4 + 8MnSO_4 + 12H_2O + 5$ 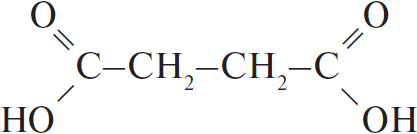
Задача 13
При сжигании 4,76 г органического вещества выделилось 6,272 л (н. у.) углекислого газа и 2,52 г воды. Данное вещество подверглось гидролизу в присутствии гидроксида калия c образованием двух солей.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу полученного органического вещества;
- составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции щелочного гидролиза этого соединения (используя гидроксид калия) (используйте структурные формулы органических веществ).
Решение
Формула вещества — $C_xH_yO_z$.
Так как вещество подвергается гидролизу с образованием двух солей, то оно может быть или сложным эфиром фенола, или ангидридом кислоты. Следовательно, в составе молекулы вещества должно быть не менее двух атомов кислорода.
М(C) = 12 г/моль, М(H) = 1 г/моль, М(O) = 16 г/моль,
М($CO_2$) = 44 г/моль, M($H_2O$) = 18 г/моль
- Количественный состав образца:
n(C) = n($CO_2$) = 6.272 / 22.4 = 0.28 моль; m(C) = 0.28 · 12 = 3.36 г
n(H) = 2n($H_2O$) = 2 · 2.52 / 18 = 0.28 моль; m(H) = 0.28 · 1 = 0.28 г
m(O) = 4.76 – 3.36 – 0.28 = 1.12 г; n(O) = 1.12 / 16 = 0.07 моль - Вычисленная формула:
x : y : z = n(C) : n(H) : n(O) =
= 0.56 : 0.56 : 0.14 = (делим на 0.14)
= 4 : 4 : 1 = (умножаем на 2)
= 8 : 8 : 2
Вычисленная формула — $C_8H_8O_2$. - Вещество может быть фениловым эфиром уксусной кислоты или одним из сложных эфиров крезола и муравьиной кислоты (3 изомера).
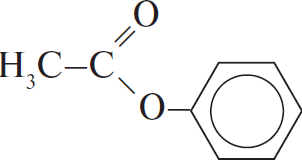
- Уравнение гидролиза:
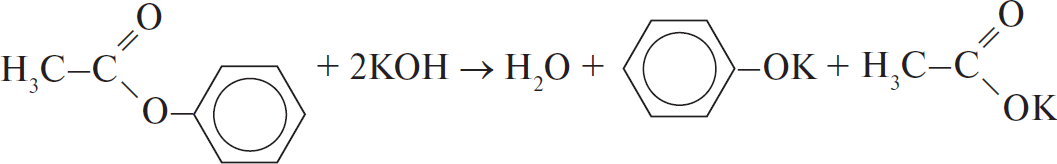
Задача 14
13,44 л (н. у.) смеси газообразного углеводорода с бромоводородом, взятых в объёмном соотношении 1 : 2, прореагировали без остатка с образованием продукта массой 40,4 г. При исследовании химических свойств углеводорода было установлено, что он реагирует с аммиачным раствором оксида серебра и при его взаимодействии с водой образуется органическое вещество, не вступающее в реакцию серебряного зеркала.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу исходного органического вещества;
- составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции гидратации углеводорода (используйте структурные формулы органических веществ).
Решение
Определено количество реагирующих веществ:
а) уравнение реакции:
$C_{n}H_{2n–2} + 2HBr → C_{n}H_{2n}Br_2$
б) т. к. $V(C_{n}H_{2n–2})$ : V(HBr) = 1 : 2, то
V($С_{n}H_{2n–2}$) = 13.44 / 3 = 4.48 л
n($С_{n}H_{2n–2}$) = 4.48 / 22.4 = 0.2 моль
в) по уравнению реакции:
n($C_{n}H_{2n}Br_2$) = n($C_{n}H_{2n–2}$) = 0.2 моль
Определена молекулярная формула вещества:
а) M($C_{n}H_{2n}Br_2$) = 40.4 / 0.2 = 202 г/моль
б) M($C_{n}H_{2n}Br_2$) = 12n + 2n + 160 = (14n + 160) г/моль
14n + 160 = 202
n = 3, молекулярная формула $C_3H_4$
Структурная формула вещества:
$CH_3–C≡CH$
Уравнение реакции гидратации:
$CH_3–C≡CH + H_2O → CH_3–CO–CH_3$
Задача 15
При сжигании образца дипептида природного происхождения массой 6,4 г получили 5,376 л (н. у.) углекислого газа, 4,32 г воды и 896 мл (н. у.) азота. При нагревании пептида в избытке раствора гидроксида натрия образуется только одно органическое вещество.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу дипептида;
- составьте структурную формулу этого дипептида, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции взаимодействия дипептида с раствором гидроксида натрия (используйте структурные формулы органических веществ).
Решение
Вариант ответа:
Рассчитан количественный состав образца:
а) n(C) = n($CO_2$) = 5.376 / 22.4 = 0.24 моль
M(C) = 12 г/моль, m(C) = 0.24 · 12 = 2.88 г
б) n(H) = 2n($H_2O$) = 2 · 4.32 / 18 = 0.48 моль
M(H) = 1 г/моль, m(H) = 0.48 · 1 = 0.48 г
в) n(N) = 2n($N_2$) = 2 · 0.896 / 22.4 = 0.08 моль
M(N) = 14 г/моль, m(N) = 0.08 · 14 = 1.12 г
г) m(O) = 6.4 – 2.88 – 0.48 – 1.12 = 1.92 г
M(O) = 16 г/моль, n(O) = 1.92 / 16 = 0.12 моль
Рассчитана молекулярная формула дипептида:
Формула вещества — $C_xH_yN_zO_w$
x : y : z : w = 0.24 : 0.48 : 0.08 : 0.12 = 3 : 6 : 1 : 1,5 = 6 : 12 : 2 : 3
Молекулярная (вычисленная) формула — $C_6H_{12}N_2O_3$
Структурная формула:
$H_2N–CH(CH_3)–C(O)–NH–CH(CH_3)–COOH$
Уравнение реакции щелочного гидролиза:
$H_2N–CH(CH_3)–C(O)–NH–CH(CH_3)–COOH + 2NaOH → 2H_2N–CH(CH_3)–COONa + H_2O$
Задача 16
При сгорании 18,8 г органического вещества получили 26,88 л (н. у.) углекислого газа и 10,8 мл воды. Известно, что это вещество реагирует как с гидроксидом натрия, так и с бромной водой (с образованием осадка белого цвета).
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу полученного органического вещества;
- составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции этого вещества с бромной водой (используйте структурные формулы органических веществ).
Решение
- Находим количественный состав образца:
а) n(C) = n($CO_2$) = 26.88 / 22.4 = 1.2 моль
m(C) = 1.2 · 12 = 14.4 г
б) m($H_2O$) = 1 · 10.8 = 10.8 г; n(H) = 2n($H_2O$) = 2 · 10.8 / 18 = 1.2 моль
m(H) = 1 · 1.2 = 1.2 г
в) m(O) = 18.8 – 14.4 – 1.2 = 3.2 г; n(O) = 3.2 / 16 = 0.2 моль - Находим вычисленную формулу $C_xH_yO_z$:
x : y : z = n(C) : n(H) : n(O) = 1.2 : 1.2 : 0.2 = 6 : 6 : 1.
Молекулярная формула — $C_6H_6O$. - Т. к. вещество реагирует со щёлочью, в нём имеется подвижный, «кислый», атом водорода; образование осадка с бромной водой — качественная реакция на фенол
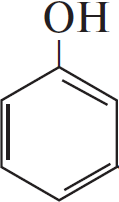
- Уравнение реакции вещества с бромной водой:
 $+ 3Br_2 → 3HBr +$
$+ 3Br_2 → 3HBr +$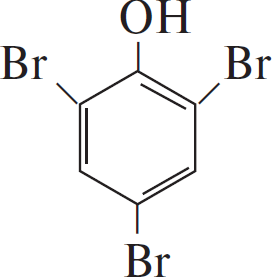
Задача 17
При взаимодействии одного и того же количества алкена с различными галогенами образуется 12,7 г дихлорпроизводного или 21,6 г дибромпроизводного. При взаимодействии алкена с водным раствором перманганата калия образуется продукт, у которого заместители находятся у вторичных атомов углерода.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу полученного органического вещества;
- составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции этого вещества с бромной водой (используйте структурные формулы органических веществ).
Решение
- Уравнения реакций взаимодействия алкена с галогенами:
$C_nH_{2n} + Cl_2 → C_nH_{2n}Cl_2$ (1)
$C_nH_{2n} + Br_2 → C_nH_{2n}Br_2$ (2) - Количество реагирующих веществ:
а) M$(C_nH_{2n}Cl_2)$ = (14n + 71) г/моль
n$(C_nH_{2n}Cl_2)$ = 12.7 / (14n + 71) моль
б) M$(C_nH_{2n}Br_2)$ = (14n + 160) г/моль
n$(C_nH_{2n}Br_2)$ = 21.6 / (14n + 160) моль - По уравнениям реакций:
n$(C_nH_{2n})$ = n$(C_nH_{2n}Cl_2)$ = n$(C_nH_{2n}Br_2)$, следовательно 12.7 / (14n + 71) = 21.6 / (14n + 160)
n = 4, формула алкена — $C_4H_8$. - Структурная формула вещества:
$CH_3–CH=CH–CH_3$ - Уравнение реакции:
$CH_3–CH=CH–CH_3 + Br_2 → CH_3–CH(Br)–CH(Br)–CH_3$
Задача 18
При прокаливании кальциевой соли карбоновой кислоты получили органическое вещество, содержащее 69,76 % углерода и 18,6 % кислорода.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу полученного органического вещества;
- составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции получения этого вещества при прокаливании кальциевой соли карбоновой кислоты (используйте структурные формулы органических веществ).
Решение
Пусть формула вещества — $C_xH_yO_z$.
- Находим количественный состав вещества:
а) ω(H) = 100 – (69.76 + 18.60) = 11.64 %
б) Пусть m($C_xH_yO_z$) = 100 г, тогда
m(C) = 69.67 г; n(C) = 69.76 / 12 ≈ 5.81 моль
m(H) = 11.64 г; n(H) = 11.64 / 1 = 11.64 моль
m(O) = 18.60 г; n(O) = 18.60 / 16 ≈ 1.16 моль - Находим молекулярную формулу вещества:
x : y : z = n(C) : n(H) : n(O) = 5.81 : 11.64 : 1.16 ≈ 5 : 10 : 1
Молекулярная формула — $C_5H_{10}O$. - Структурная формула вещества:
$CH_3–CH_2–C(O)–CH_2–CH_3$ - Уравнение получения вещества:
$(CH_3CH_2COO)_2Ca → CaCO_3 + CH_3CH_2–C(O)–CH_2CH_3$
Задача 19
При сжигании 2,8 г газообразного органического вещества выделилось 8,8 г углекислого газа и 3,6 г воды. Плотность вещества 2,5 г/л. В ходе исследования химических свойств этого вещества установлено, что при взаимодействии вещества с бромоводородом образуется единственное галогенпроизводное с атомом галогена на концевом атоме углерода.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу полученного органического вещества;
- составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции этого вещества с бромоводородом.
Решение
- Находим количественный состав вещества.
Формула вещества — $C_xH_yO_z$.
а) n(C) = n($CO_2$) = 8.8 / 44 = 0.2 моль
m(C) = 0.2 · 12 = 2.4 г
б) n(H) = 2n($H_2O$) = 3.6 / 18 = 0.4 моль
m(H) = 0.4 · 1 = 0.4 г
в) m(O) = 2.8 – 2.4 – 0.4 = 0 г, кислорода в веществе нет - Определяем молекулярную формулу вещества:
а) (так как плотность это отношение массы к объему) $M_{ист.}(C_xH_y) = m_{в-ва}$ · $V_М$ / $V_г$ = 2.5 · 22.4 / 1 = 56 г/моль
б) x : y = n(C) : n(H) = 0.2 : 0.4 = 1 : 2
Вычисленная формула — $CH_2$.
$M_{выч.}(CH_2)$ = 14 г/моль
в) $M_{ист.}(C_xH_y)$ / $M_{выч.}(CH_2)$ = 56 / 14 = 4
Молекулярная формула исходного вещества — $C_4H_8$. - Составляем структурную формулу вещества:
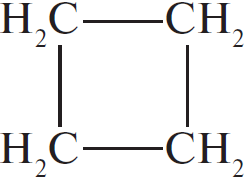
- Уравнение реакции вещества с бромоводородом:
 $+ HBr → CH_3–CH_2–CH_2–CH_2Br$
$+ HBr → CH_3–CH_2–CH_2–CH_2Br$
Задача 20
При сжигании образца пептида массой 4 г получили 3,36 л (н. у.) углекислого газа, 2,7 г воды и 560 мл (н. у.) азота. Известно, что это вещество образует соль при взаимодействии с кислотами, а при взаимодействии с водным раствором щёлочи образуется только одна соль.
На основании данных условия задания:
- проведите необходимые вычисления (указывайте единицы измерения искомых физических величин) и установите молекулярную формулу полученного органического вещества;
- составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
- напишите уравнение реакции пептида с водным раствором щелочи (используйте структурные формулы органических веществ).
Решение
Пусть формула вещества — $C_xH_yN_zO_w$, тогда:
1) m(C) = n($CO_2$) = $V_г$ / $V_M$ = 3.36 / 22.4 = 0.15 мольm(C) = 0.15 · 12 = 1.8 г
n(H) = 2n($H_2O$) = $m_{в-ва}$ / $M_{в-ва}$ = 2 · 2.7/18 = 0.3 моль
m(H) = 0.3 · 1 = 0.3 г
n(N) = 2n($N_2$) = $V_г$ / $V_M$ = 2 · 0.560 / 22.4 = 0.05 моль
m(N) = 0.05 · 14 = 0.7 г
m(O) = 4 – (1.8 + 0.3 + 0.7) = 1.2 г
n(O) = $m_{в-ва}$ / $M_{в-ва}$ = 1.2 / 16 = 0.075 моль
2) x : y : z : w = n(C) : n(H) : n(N) : n(O) = 0.15 : 0.30 : 0.05 : 0.075 = 3 : 6 : 1 : 1.5 = 6 : 12 : 2 : 3
Вычисленная формула — $C_6H_{12}N_2O_3$.
3) Структурная формула вещества:
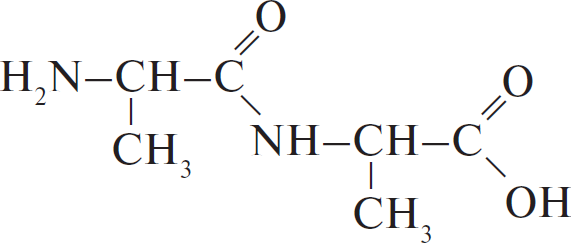
4) Уравнение реакции:
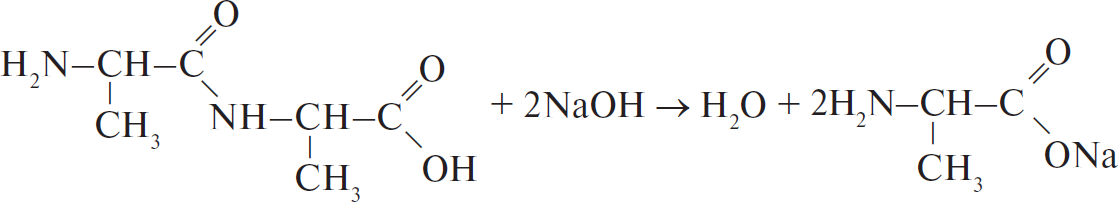
Рекомендуемые курсы подготовки

- Разберешься с заданием №17 на классификацию реакций
- Научишься решать задание №18 на скорость реакции
- Познакомишься с химическим равновесием и научишься рассчитывать равновесные концентрации веществ
- Научишься решать задания №22 и №23
- Научишься решать задание №27 на тепловой эффект
на бесплатном курсе Турбо ЕГЭ

