Скорость химических реакций
Различные химические реакции идут с разной скорость – уксус мгновенно реагирует с пищевой содой, а серебряное кольцо очень медленно на воздухе покрывается темным налетом сульфида серебра.
Скорость химической реакции – это изменение концентрации исходных веществ или продуктов реакции в единицу времени.
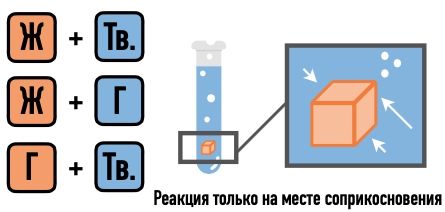
Скорость химической реакции зависит от агрегатного состояния веществ, вступающих во взаимодействие. Если все реагенты находятся в одной фазе (нет границы раздела фаз), то реакция гомогенная. В этом случае реакция идет в объеме веществ.
Гомогенные реакции – это реакции между газами или между взаимно растворимыми жидкостями (растворами). К гомогенным относят реакции, в ходе которых нельзя заметить границы раздела фаз (вещества находятся в одном и том же агрегатном состоянии и растворимы друг в друге), например раствор кислоты + раствор щелочи, газообразный водород + газообразный азот и др.

В гетерогенных реакциях наоборот, граница раздела фаз есть, и как раз на ее поверхности и протекает химическая реакция. Примеры гетерогенных процессов: Zn + HCl, C + $O_2$. В случае таких реакций на скорость оказывает сильное влияние площадь поверхности твердых веществ. Чем она больше, тем быстрее будет идти процесс.
Вы скажете, что гомогенная реакция удобнее, круче. И будете правы.
Что нужно, чтобы реакция пошла быстрее? Чем больше частиц встретится между собой и чем выше будет их энергия, тем быстрее пойдет реакция. Поэтому, в целом, все факторы, влияющие на скорость реакции, так или иначе влияют на количество встреч частиц (например, молекул) между собой и на их энергию.
Факторы, влияющие на скорость химической реакции:
1) Природа реагирующих веществ
Реакционная активность соединений зависит от характера химических связей в веществах и их строения. Ионные соединения и соединения с ковалентными полярными связями намного быстрее превращаются, чем соединения со слабополярными или неполярными химическими связями. Например, какой-нибудь металл или оксид будет быстрее реагировать с сильной кислотой, чем со слабой.
2) Концентрация исходных веществ
При увеличении концентрации газа или жидкости скорость химической реакции увеличивается и наоборот. Помни, что концентрации твердых веществ на скорость не влияют!
В случае газообразных веществ давление влияет на скорость реакции так же, как и концентрация. При увеличении давления скорость реакции будет возрастать. При этом не учитываются твердые вещества.
3) Температура

Cкорость химической реакции увеличивается с ростом температуры.
Правило Вант-Гоффа
Повышение температуры на каждые 10 градусов приводит к увеличению скорости большинства реакций в 2 – 4 раза.
Скорость реакции зависит от энергии реагирующих частиц. Если бы все молекулы водорода и молекулы кислорода имели достаточную для реакции энергию, то реакция между ними с образованием воды протекала бы мгновенно при комнатной температуре. Но реакция идет бурно и со взрывом только при нагревании до 700С.
Частицы, которые имеют достаточную для реакции энергию называют активными. А повышение температуры увеличивает количество активных частиц, переводит неактивную частицу в активную, значит, повышает скорость реакции. Понижение температуры действует в обратную сторону.
Количество активных частиц можно повысить и другим способом – катализатором.
4) Использование катализатора или ингибитора
Энергия, необходимая для перевода 1 моль неактивных частиц в активные называется энергией активации реакции. Эта энергия зависит и от природы реагирующих веществ (возвращаемся в п. 1). Чем она меньше, тем быстрее идет реакция.
Вещества, которые увеличивают скорость химической реакции, но сами не затрачиваются в процессе ее протекания, называют катализаторами.
Вещества, обратные по действию катализаторам, называют ингибиторами.
Реакции, которые протекают только в присутствии катализаторов, называют каталитическими реакциями.
По сути, действие катализатора заключается в снижении энергии активации реакции, а значит больше частиц попадают в диапазон активных, и скорость реакции увеличивается.
Основные каталитические реакции в неорганической химии:
| 2Al + 3$I_2$ = 2$AlI_3$ | kt = $H_2O$ |
| 2$KClO_3$ = 2KCl + 3$O_2$ | kt = $MnO_2$ |
| 2$H_2O_2$ = 2$H_2O$ + $O_2$ | kt = $MnO_2$ |
| 2$SO_2$ + $O_2$ = 2$SO_3$ | kt = $V_2O_5$ |
| 4$NH_3$ + 5$O_2$ = 4NO + 6$H_2O$ | kt = Pt |
| С + 2$H_2$ = $CH_4$ | kt = hν (свет) |
| $N_2$ + 3$H_2$ = 2$NH_3$ | kt = Fe |
5) Измельчение твердых исходных реагентов
Чем больше площадь твердого вещества, тем быстрее будет идти гетерогенная реакция на границе раздела фаз.



