Задание 21. Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная. ЕГЭ 2026 по химии
Средний процент выполнения: 72.8%
Ответом к заданию 21 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Подпишись на суперполезные материалы

Задачи для практики
Задача 1
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.
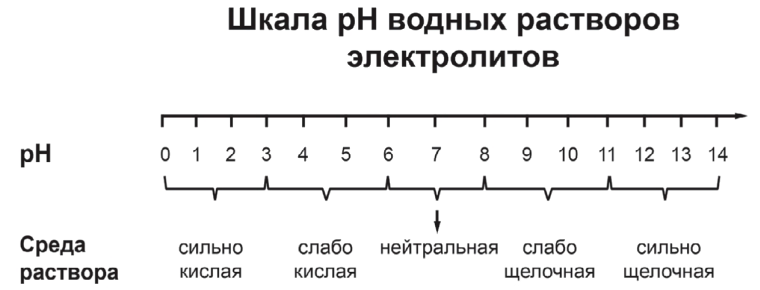
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) $LiOH$
2) $Mg(NO_3)_2$
3) $CaCl_2$
4) $Li_2S$
Запишите номера веществ в порядке уменьшения значения pH их водных растворов.
Решение
1) Гидроксид лития. Сильное основание. Среда щелочная.
2) Нитрат магния. Соль сильной кислоты и слабого основания. Гидролиз по катиону. Среда слабокислая.
3) Хлорид кальция. Соль сильной кислоты и сильного основания. Гидролиза нет. Среда нейтральная.
4) Сульфид лития. Соль слабой кислоты и сильного основания. Гидролиз по аниону. Среда слабощелочная.
Выстраиваем в ряд по уменьшению значения pH: 1, 4, 3, 2
Задача 2
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

Для веществ, приведённых в перечне, определите среду их водных растворов с одинаковой молярной концентрацией.
- Cu(NO3)2
- Li2S
- NaOH
- CaCl2
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Решение
- Соль, образованная слабым основанием и сильной кислотой. Среда слабокислая.
- Соль, образованная сильным основанием и слабой кислотой. Среда слабощелочная.
- Сильное основание - сильнощелочная среда.
- Соль, образованная сильным основанием и сильной кислотой. Среда нейтральная.
Задача 3
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) $H_2SO_4$
2) $KMnO_4$
3) $NH_4OH$
4) $Ba(NO_2)_2$
Запишите номера веществ в порядке увеличения значения pH их водных растворов.
Решение
Разберемся какую среду раствора создают эти вещества:
А) Сильная кислота, среда сильнокислая
Б) Соль сильного основания и сильной кислоты, гидролиза нет, среда нейтральная
В) Слабое растворимое основнание, среда щелочная
Г) Соль сильного основания и слабой кислоты, среда слабощелочная
Задача 4
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) $Ca(OH)_2$
2) $NH_4I$
3) $HMnO_4$
4) $KNO_3$
Запишите номера веществ в порядке уменьшения значения pH их водных растворов.
Решение
1) Гидроксид кальция. Щелочь. Среда щелочная.
2) Йодид аммония, соль сильной кислоты и слабого основания. Гидролиз по катиону. Среда слабокислая.
3) Марганцевая кислота. Сильная. Среда кислая.
4) Нитрат калия, соль сильной кислоты и сильного основания. Гидролиза нет. Среда нейтральная.
Выстраиваем в ряд по уменьшению значения pH: 1, 4, 2, 3
Задача 5
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

Для веществ, приведённых в перечне, определите среду их водных растворов с одинаковой молярной концентрацией.
- Na3PO4
- Na2HPO4
- Na2SO4
- NaHSO4
Запишите номера веществ в порядке убывания значения pH их водных растворов.
Решение
- Соль, образованная сильным основанием и слабой кислотой: среда слабощелочная.
- Соль, образованная сильным основанием и слабой кислотой: среда слабощелочная, но засчет дополнительных протонов чуть менее, чем в варианте 1.
- Соль, образованная сильным основанием и сильной кислотой: среда нейтральная.
- Кислая соль сильной кислоты: среда сильнокислая засчет диссоциации.
Задача 6
Для веществ, приведённых в перечне, определите среду их водных растворов с одинаковой молярной концентрацией.
- нитрат бария
- хлорид железа(III)
- хлорид водорода
- ацетат калия
Запишите номера веществ в порядке убывания значения pH их водных растворов.
Решение
Вещества 1,2 и 4 являются солями, а вещество 3 - сильная соляная кислота. У кислоты будет самый низкий pH. В случае остальных солей смотрим на гидролиз:
Нитрат бария не гидролизуется, pH нейтральный.
Хлорид железа(III) гидролизуется по катиону, pH слабокислый.
Ацетат калия гидролизуется по аниону, pH слабощелочной
Итоговая последовательность по уменьшению pH: 4123
Задача 7
Установите соответствие между исходными веществами, условиями электролиза и продуктами электролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой
| ВЕЩЕСТВА И УСЛОВИЯ ЭЛЕКТРОЛИЗА | ПРОДУКТЫ ЭЛЕКТРОЛИЗА |
| А) раствор хлорида кальция с графитовыми электродами Б) раствор сульфата меди(II) с графитовыми электродами В) раствор сульфата меди(II) с медными электродами Г) раствор сульфата цинка c цинковыми электродами |
1) Cl2, H2 2) Сa(OH)2, Cl2, H2 3) Cu, O2, H2SO4 4) Cu, H2, O2, H2SO4 5) анод растворяется, на катоде выделяется металл 6) анод растворяется, на катоде выделяются металл и водород |
Запишите выбранные цифры под соответствующими буквами.
Решение
В случае раствора хлорида на аноде выделится хлор. Из растворов сульфатов на аноде выделится кислород. Металлические аноды будут при этом растворяться. На катоде в случае кальция будет выделяться водород (т.к. Ca - активный металл), в случае меди будет выделяться сама медь (т.к. Cu - малоактивный металл), в случае цинка - будет происходить одновременное образование металла и водорода.
Задача 8
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) $H_2S$
2) $NaI$
3) $Ca(NO_2)_2$
4) $Ba(OH)_2$
Запишите номера веществ в порядке уменьшения значения pH их водных растворов.
Решение
1) Сероводородная кислота. Слабая. Среда кислая.
2) Йодид натрия, соль сильной кислоты и сильного основания. Гидролиза нет. Среда нейтральная.
3) Нитрит кальция, соль слабой кислоты и сильного основания. Гидролиз по аниону. Среда слабощелочная.
4) Щелочь - среда щелочная.
Выстраиваем в ряд по уменьшению значения pH: 4, 3, 2, 1
Задача 9
Для веществ, приведённых в перечне, определите среду их водных растворов с одинаковой молярной концентрацией.
- NH3∙H2O
- NH4Cl
- Na2CO3
- Na2SO4
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Решение
Проанализируем состав веществ:
1. Это водный раствор аммиака. Является слабым основанием, поэтому слабощелочная.
2. NH4Cl: остаток слабого основания, НО сильной кислоты. Среда слабокислая.
3. Na2CO3: остаток сильного основания, но слабой кислоты. Значит слабощелочная среда (но чуть менее, чем раствор аммиак)
4. Na2SO4: в соли нет ничего слабого, поэтому гидролиз не идет; pH=7
Задача 10
Для веществ, приведённых в перечне, определите среду их водных растворов с одинаковой молярной концентрацией.
- KF
- $H_2SO_4$
- $Ba(OH)_2$
- $MnSO_4$
Запишите номера веществ в порядке убывания значения pH их водных растворов.
Решение
- Соль, образованная сильным основанием и слабой кислотой. Среда слабощелочная.
- Сильная кислота. Среда сильнокислая.
- Сильное основание - сильнощелочная среда.
- Соль, образованная слабым основанием и сильной кислотой. Среда слабокислая.
Задача 11
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

Для веществ, приведённых в перечне, определите среду их водных растворов с одинаковой молярной концентрацией.
- FeCl3
- Ca(OH)2
- KF
- BaCl2
Запишите номера веществ в порядке убывания значения pH их водных растворов.
Решение
Задача 12
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

Для веществ, приведённых в перечне, определите среду их водных растворов с одинаковой молярной концентрацией.
- нитрат калия
- гидроксид натрия
- хлорид алюминия
- карбонат натрия
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Решение
Задача 13
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) $Li_2S$
2) $KClO_3$
3) $HBrO_4$
4) $NaOH$
Запишите номера веществ в порядке уменьшения значения pH их водных растворов.
Решение
1) Сульфид лития, соль слабой кислоты и сильного основания. Гидролиз по аниону. Среда слабощелочная.
2) Хлорат калия, соль сильной кислоты и сильного основания. Гидролиза нет. Среда нейтральная.
3) Бромная кислота. Сильная. Среда кислая.
4) Щелочь - среда щелочная.
Выстраиваем в ряд по уменьшению значения pH: 4, 1, 2, 3
Задача 14
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

Для веществ, приведённых в перечне, определите среду их водных растворов с одинаковой молярной концентрацией.
- ацетат аммония
- сероводород
- аммиак
- хлороводород
Запишите номера веществ в порядке убывания значения pH их водных растворов.
Решение
- Соль, образованная слабыми кислотой и основанием. Среда нейтральная.
- Слабая кислота. Среда слабокислая.
- Слабое основание. Среда слабощелочная.
- Сильная кислота. Среда сильнокислая.
Задача 15
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) $LiCl$
2) $RbOH$
3) $KOH$
4) $Na_2SO_3$
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
Решение
Определим характер среды в каждом из растворов:
1) Соль сильной кислоты и сильного основания, среда нейтральная
2) Сильное основание, щелочь, среда сильнощелочная
3) Сильное основание, щелочь, среда сильно щелочная
4) Соль сильного основания и слабой кислоты, среда слабощелочная
У нас получилась некая зависимость, но как выбрать в растворе какой щелочи среда более щелочная? Основность гидроксидов металлов увеличивается сверху вниз по группе, значит среда будет более щелочной в растворе RbOH, а не KOH
Получается, pH растворов веществ увеличивается в порядке 1 - 4 - 3 - 2
Задача 16
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) $Ca(OH)_2$
2) $LiCl$
3) $CH_3COOH$
4) $HCl$
Запишите номера веществ в порядке увеличения значения pH их водных растворов.
Решение
Определим среду растворов каждого из веществ:
1. Щелочь, среда сильнощелочная.
2. Соль сильного основания и сильной кислоты, гидролиза нет, среда нейтральная.
3. Слабая кислота, среда слабокислая.
4. Сильная кислота, среда сильнокислая.
Задача 17
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) $HClO_3$
2) $FeBr_3$
3) $KOH$
4) $(CH_3COO)_2Ba$
Запишите номера веществ в порядке увеличения значения pH их водных растворов.
Решение
1) Хлорноватая кислота. Сильная. Среда кислая.
2) Бромид железа(III). Соль сильной кислоты и слабого основания. Гидролиз по катиону. Среда слабокислая.
3) Гидроксид калия. Сильное основание. Среда щелочная.
4) Ацетат бария, соль слабой кислоты и сильного основания. Гидролиз по аниону. Среда слабощелочная.
Выстраиваем в ряд по увеличению значения pH: 1, 2, 4, 3
Задача 18
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) $Fe_2(SO_4)_3$
2) $Na_2Cr_2O_7$
3) $LiOH$
4) $HNO_3$
Запишите номера веществ в порядке уменьшения значения pH их водных растворов.
Решение
1. $Fe_2(SO_4)_3$ - соль сильной кислоты и слабого основания. Будет идти гидролиз по катиону. Среда слабокислая.
2. $Na_2Cr_2O_7$ - соль сильной кислоты и сильного основания. Гидролиз не протекает. Среда нейтральная.
3. $LiOH$ - щелочь, сильное основание. Среда щелочная.
4. $HNO_3$ - сильная кислота. Среда кислая.
pH уменьшается от щелочной среды к кислой: 3214
Задача 19
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) $ZnCl_2$
2) $NaOH$
3) $H_3PO_4$
4) $HNO_3$
Запишите номера веществ в порядке увеличения значения pH их водных растворов.
Решение
1) Хлорид цинка. Соль сильной кислоты и слабого основания. Гидролиз по катиону. Среда слабокислая.
2) Гидроксид натрия. Сильное основание. Среда щелочная.
3) Фосфорная кислота. Слабая кислота. Среда кислая.
4) Азотная кислота. Сильная кислота. Среда еще более кислая.
Выстраиваем в ряд по увеличению значения pH: 4, 3, 1, 2
Задача 20
Для выполнения задания 21 используйте следующие справочные данные.
Концентрация (молярная, моль/л) показывает отношение количества растворённого вещества (n) к объёму раствора (V).
pH («пэ аш») – водородный показатель; величина, которая отражает концентрацию ионов водорода в растворе и используется для характеристики кислотности среды.

Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) $HNO_3$
2) $H_3PO_4$
3) $RbF$
4) $Ba(NO_3)_2$
Запишите номера веществ в порядке уменьшения значения pH их водных растворов.
Решение
1) Азотная кислота. Сильная кислота. Среда кислая.
2) Фосфорная кислота. Слабая. Среда менее кислая.
3) Фторид рубидия. Соль слабой кислоты и сильного основания. Гидролиз по аниону. Среда слабощелочная.
4) Нитрат бария. Соль сильной кислоты и сильного основания. Гидролиза нет. Среда нейтральная.
Выстраиваем в ряд по уменьшению значения pH: 3, 4, 2, 1
Рекомендуемые курсы подготовки

- Разберешься с заданием №17 на классификацию реакций
- Научишься решать задание №18 на скорость реакции
- Познакомишься с химическим равновесием и научишься рассчитывать равновесные концентрации веществ
- Научишься решать задания №22 и №23
- Научишься решать задание №27 на тепловой эффект
на бесплатном курсе Турбо ЕГЭ

