Химическое равновесие
Необратимые реакции
Некоторые химические реакции идут только в одном направлении, например:
BaCl2 + H2SO4 ↓ → BaSO4↓ + 2HCl
Обратная реакция BaSO4 + HCl невозможна. Такие реакции называют необратимыми. Обычно, это реакции, в результате которых хотя бы один из продуктов выводится из реакционной смеси. Такое происходит, например, когда в растворе выпадает осадок или выделяется газ. Необратимую реакцию легко определить – если ты не можешь провести обратную реакцию, то реакция необратима.
Необратимыми являются и некоторые реакции разложения:
2KClO3 → 2KCl + 3O2
Но и обратимые реакции разложения тоже есть:
4HNO3 ↔ 2H2O + 4NO2 + O2
Обратимые реакции
В ходе обратимой реакции параллельно протекают как прямая реакция, так и обратная реакция, как в случае синтеза аммиака из азота и водорода:
прямая реакция N2 + 3H2 ↔ 2NH3
обратная реакция 2NH3 ↔ N2 + 3H2
Обратимую реакцию определяем так – если реакцию можно провести в обратном направлении, то реакция обратима. Все максимально логично)
В ходе любой обратимой химической реакции наступает момент, когда скорости прямой и обратной реакций становятся равны. Тогда наступает химическое равновесие.
Химическое равновесие – это определенное состояние реакционной системы, при котором концентрация реагирующих веществ и продуктов реакции не изменяется во времени, так как скорости прямой и обратной реакции равны и отличны от нуля.
Смещение равновесия – это переход системы из одного равновесного состояния в другое, соответствующее изменившимся условиям.

Куда и как сместится равновесие определяется принципом Ле Шателье:
Если изменить одно из условий (концентрация, температура, давление), при котором система находится в состоянии химического равновесия, то равновесие сместится в сторону той реакции, которая это изменение условий сводит к минимуму.
Перевод на человеческий: cистема будет делать все, чтобы вам противодействовать: вы нагреваете? Пускаем реакцию, где температура будет поглощаться. Вы увеличиваете концентрацию кого-то? Смещаем в сторону, где этого вещества не будет. Вот этой системе лишь бы наоборот.
Факторы, влияющие на химическое равновесие:
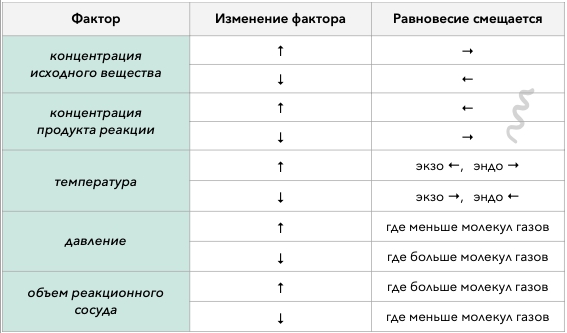
1) Изменение концентрации
При увеличении концентрации одного из веществ (жидкого или газообразного), равновесие смещается в сторону уменьшения его концентрации, то есть в сторону той реакции, где это вещество затрачивается, а не образуется.
H2 + I2 ↔ 2HI
Если увеличить концентрацию исходного вещества H2 (или I2), то равновесие сместится в сторону образования HI, то есть в сторону прямой реакции (в сторону продуктов).
Если увеличить концентрацию продукта реакции HI, то равновесие сместится в сторону образования H2 и I2, то есть в сторону обратной реакции (в сторону исходных веществ).
Концентрация или добавление твердых веществ в реакции на химическое равновесие не влияет!
2) Изменение температуры
Изменение температуры влияет сразу на обе реакции – прямую и обратную. Но понижение температуры смещает равновесие по большей части в сторону экзотермической реакции, а повышение температуры – в сторону эндотермической. Нам нужно знать тепловой эффект реакции, чтобы выяснить куда сместится равновесие. В заданиях ЕГЭ, где нужно определить смещение равновесия, дается тепловой эффект реакции.
N2 + O2 ↔ 2NO – Q
При повышении температуры равновесие сместится в сторону образования NO, в сторону продукта реакции.
Как ты знаешь, если прямая реакция эндотермическая, то обратная реакция экзотермическая. Значит, при понижении температуры равновесие сместится в сторону образования N2 и O2, то есть в сторону исходных веществ.
3) Изменение давления
Изменение давления будет влиять только на те реакции, в ходе которых образуется или участвует хотя бы одно газообразное вещество. Важное условие – число газообразных молекул в исходных веществах должно отличаться от числа молекул газов в продуктах реакции, иначе изменение давления не влияет на равновесие
N2 + 3H2 ↔ 2NH3
Повышение давления в системе сместит равновесие туда, где находится меньше моль газа. Слева 1N2 + 3H2 = 4 моль, а справа 2 моль NH3. Значит равновесие сместится в сторону образования NH3, в сторону продукта.
Понижение давления, наоборот, сместит равновесие туда, где находится больше моль газа – в сторону исходных веществ.
4) Изменение объема реакционного сосуда (колбы, например)
При увеличении объема реакционного сосуда уменьшается давление, а значит и смещение будет в ту сторону, куда оно смещается при уменьшении давления.
При уменьшении объема реакционного сосуда увеличивается давление, а значит и смещение будет в ту сторону, куда оно смещается при увеличении давления.
Катализаторы не влияют на смещение химического равновесия, поскольку в равной степени ускоряют как прямую, так и обратную реакции. Они лишь ускоряют его достижение.
При решении заданий можно подсмотреть сюда: