Задание 17. Классификация химических реакций в неорганической и органической химии. ЕГЭ 2026 по химии
Средний процент выполнения: 60%
Ответом к заданию 17 по химии может быть последовательность цифр, чисел или слов. Порядок записи имеет значение.
Подпишись на суперполезные материалы

Задачи для практики
Задача 1
Из предложенного перечня выберите все суждения, которые справедливы для реакции взаимодействия этилена с бромной водой.
- относится к окислительно-восстановительным реакциям
- повышение давления увеличивает скорость реакции
- относится к необратимым реакциям
- охлаждение не влияет на скорость реакции
- относится к радикальным реакциям
Запишите номера выбранных ответов.
Решение
Алкен с бромной водой: идет присоединение по кратной связи. При этом бром ионизируется (5 не подходит), а степени окисления меняются (1 подходит).
Охлаждение всегда влияет на скорость реакции - замедляет ее (4 не подходит).
Давление увеличит скорость, если слева есть газы. Проверяем: $C_2H_4 + Br_2 = C_2H_4Br_2$ - этилен газ, так что берем 2.
Реакция необратима - в обратном направлении не идет, так просто углеводород уже свои галогены не теряет!
Задача 2
Установите соответствие между уравнением реакции и её типом: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
А) 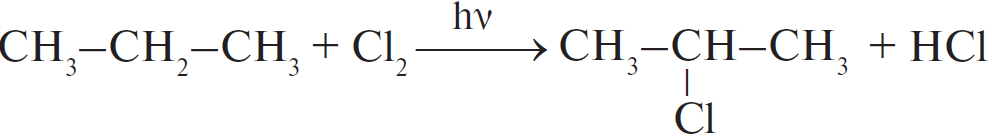 Б) 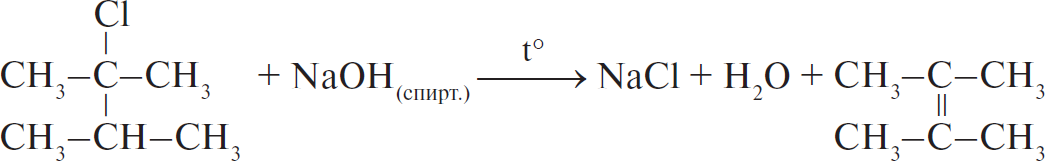 В) 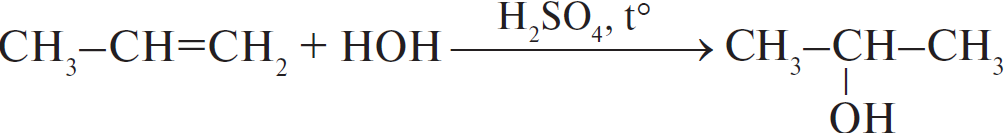 Г) 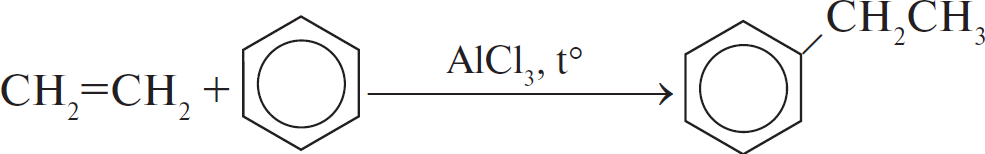 |
1) отщепление 2) присоединение 3) замещение 4) обмен |


