Задание 26. Расчёты с использованием понятия «массовая доля вещества в растворе». ЕГЭ 2026 по химии
Средний процент выполнения: 64.6%
Ответом к заданию 26 по химии может быть целое число или конечная десятичная дробь.
Подпишись на суперполезные материалы

Задачи для практики
Задача 1
Сколько грамм сульфата натрия (растворимость при комнатной температуре составляет 19,2 г/100 г воды) понадобится для приготовления 50 г насыщенного раствора? Ответ запишите с точностью до целых.
Решение
19,2 г вещества растворяется в 119,2 г насыщ. раствора
x г вещества растворится в 50 г насыщ. раствора
x = 19,2⋅50/119,2 = 8 г
Задача 2
К 140 г насыщенного при комнатной температуре раствора сульфата натрия (растворимость составляет 19,2 г/100 г воды) добавили 84 г воды. Вычислите массовую долю полученного раствора. Ответ запишите в процентах с точностью до целых.
Решение
Массовая доля вещества в насыщенном растворе: $𝒘_{nas} = 19,2/119,2 = 0,16$
Масса вещества в 140 г раствора: $m_{K_2SO_4} = 140⋅0,16 = 22,4$ г
Массовая доля нового раствора: $𝒘 = 22,4/(140+84) = 22,4/224 = 0,1$ или 10%
Задача 3
Определите массу соли, которую необходимо добавить к 200 г раствора с массовой долей нитрата калия 10 %, чтобы получить раствор с массовой долей 12%. (Запишите число с точностью до десятых.)
Решение
Составляем уравнение для новой массовой доли: 𝜔 = 0,12 = (200*0,1 + x)/(200+x)
20+x=24+0,12x
0,88x=4
x=4,5 г
Задача 4
400 г раствора бромида калия с массовой долей соли 45 % нагрели до кипения, при этом испарилось 50 г воды. Определите массу бромида калия в растворе после его охлаждения до 20 °C. Растворимость соли при температуре 20 °C равна 65 г на 100 г воды. (Запишите число с точностью до десятых.)
Решение
m(KBr)исх. = 400⋅0,45 = 180 г
m(р-ра)после_кип. = 400-50 = 350 г
m(H2O) = 350 - 180 = 170 г.
Переходим к растворимости (составим пропорцию):
65 г вещества максимально может раствориться в 100 г воды
x г вещества максимально может раствориться в 170 г воды
x = 110,5 г.
Задача 5
Сколько грамм сульфата натрия (растворимость при комнатной температуре составляет 19,2 г/100 г воды) нужно растворить в 60 г воды для получения насыщенного раствора? Ответ запишите через запятую с точностью до сотых.
Решение
19,2 г вещества растворяется в 100 г воды
x г вещества растворится в 60 г воды
x = 19,2⋅60/100 = 11,52 г
Задача 6
400 г раствора бромида калия с массовой долей соли 45 % нагрели до кипения, при этом испарилось 50 г воды. Определите массу осадка бромида калия, который выпадет после охлаждения раствора до 20 °C. Растворимость соли при температуре 20 °C равна 65 г на 100 г воды. (Запишите число с точностью до целого.)
Решение
Вычислим концентрацию насыщенного раствора при 20С: 𝜔 = 65/165 = 0,3939
Вычислим массу вещества в исходном растворе: m = 400⋅0,45 = 180 г
Вычислим массу воды в конечном растворе: m(H2O) = 400-180-50 = 170 г
Вычислим, сколько вещества может быть растворено в таком кол-ве воды при 20С: 0.3939 = x/(170+x)
x = 109,72 г
Вычисли массу осадка: m = 180-109,72 = 70,23 ≈ 70 г
Задача 7
Сколько моль воды ($H_2O$) надо выпарить из 60 г 10%-го раствора соли, чтобы ее концентрация (соли) повысилась на 15%? Ответ укажите в молях с точностью до целых.
Решение
Масса вещества в растворе: m(в-ва) = 60 ⋅ 0,1 = 6 г
Запишем выражением для новой концентрации соли (была 10%, а потом увеличилась на 15%; итого 25%). При выпаривании воды масса растворенного вещества не поменялась. Стала другой только масса нового раствора: $𝜔 = 0,25 = 6/m_2$
Отсюда масса раствора после выпаривания: $m_2 = 6/0,25$ = 24 г
Масса выпаренной воды: m(вып.) = 60 - 24 = 36 г
Кол-во вещества выпаренной воды: $n = m/M_r = 36/18$ = 2 моль
Задача 8
Смешали 200 г 10 %-ного и 400 г 20 %-ного раствора хлорида натрия, и из раствора выпарили 30 г Н2О. Вычислите массовую долю соли в полученном растворе. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Массовая доля хлорида натрия в 3-м растворе вычисляется по формуле:
$ω_3(NaCl) = {m_3(NaCl)}/{m_{р-ра 3}} = {m_1(NaCl) + m_2(NaCl)}/{m_{р-ра 1} + m_{р-ра 2} – m(H_2O)}$,
где $m_1(NaCl)$ и $m_2(NaCl)$ — массы NaCl в 1-м и во 2-м растворах,
$m_{р-ра 1}$ и $m_{р-ра 2}$ — массы 1-го и 2-го растворов соответственно,
$m(H_2O)$ — масса испарившейся воды.
Массы хлорида натрия в 1-м и 2-м растворах можно найти по формулам:
$m_1(NaCl) = ω_1 · m_{р-ра 1}(NaCl)$
$m_2(NaCl) = ω_2 · m_{р-ра 2}(NaCl)$
Проводим вычисления:
1) $m_1(NaCl)$ = 0.1 · 200 = 20 г
2) $m_2(NaCl)$ = 0.2 · 400 = 80 г
3) $m_3(NaCl)$ = 20 + 80 = 100 г
4) $m_{р-ра 3}$ = 200 + 400 – 30 = 570 г
5) $ω_3(NaCl)$ = 100 / 570 ≈ 0.1754, или 17.54 %
Задача 9
Смешали 60 г раствора гидроксида калия с массовой долей 15 % и 140 г раствора этого же вещества с массовой долей 18 %. Вычислите массу щёлочи в полученном растворе. (Запишите число с точностью до десятых.) Ответ в (г).
Решение
Найдем массу гидроксида в первом растворе, умножив массовую долю на массу раствора:
m(KOH, 1 раствор) = 60 * 0.15 = 9 г.
Таким же образом найдем массу вещества во втором растворе:
m(KOH, 2 раствор) = 140 * 0.18 = 25.2 г.
А теперь просто сложим массы и получим общую массу гидроксида калия в конечном растворе:
m(KOH, кон.) = 25.2 + 9 = 34.2 г.
Задача 10
Вычислите массовую долю сульфата натрия в растворе, полученном добавлением 100 мл воды к 250 г 15 %-ного раствора соли. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Составим рисунок, схематически отображающий происходящие процессы.
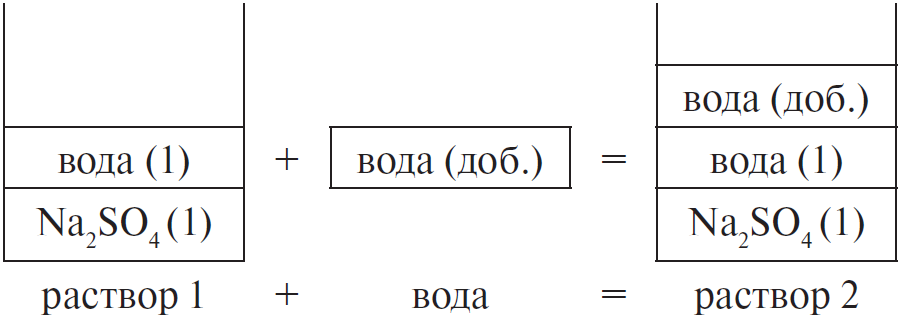
Массовая доля сульфата натрия во 2-м растворе вычисляется по формуле:
$ω_2(Na_2SO_4) = {m_2(Na_2SO_4)}/{m_{р-ра 2}},$
где $m_2(Na_2SO_4)$ — масса $Na_2SO_4$ во 2-м растворе,
$m_{р-ра 2}$ — масса 2-го раствора.
Очевидно, что:
1) масса сульфата натрия не изменяется, т. е. $m_1(Na_2SO_4) =$
$m_2(Na_2SO_4)$. Массу сульфата натрия в 1-м растворе можно найти
по формуле:
$m_1(Na_2SO_4) = ω_1 · m_{р-ра 1}(Na_2SO_4)$
2) масса второго раствора равна сумме масс первого раствора
и добавленной воды, т. е.:
$m_{р-ра 2} = m_{р-ра 1} + m(H_2O)_{доб.}$
Проводим вычисления:
1) $m_1(Na_2SO_4) = 0.15 · 250 = 37.5$ г
2) $m(H_2O) = ρ · V = 1 · 100 = 100$ г
$m_{р-ра 2} = 250 + 100 = 350$ г
3) $ω_2(Na_2SO_4) = 37.5 / 350 ≈ 0.1071$, или $10.71$ %
Задача 11
Сколько граммов хлорида натрия необходимо растворить в 50 г воды для приготовления раствора с массовой долей соли 20 %? (Запишите число с точностью до десятых.) Ответ в (г).
Решение
Раз соли в растворе 20%, то воды будет 80%
Составим пропорцию:
50 г. – 80%
X г. – 20%
Теперь составим уравнение и решим его:
50*20 = 80X
X = 12.5 г.
Задача 12
К 480 г раствора соли с массовой долей 10 % добавили 320 мл воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до целых.) Ответ в (%).
Решение
Массовая доля – отношение массы вещества к массе раствора.
Найдем массу конечного раствора, сложив массу изначального с добавляемым:
$m_к = m_1 + m_2$ = 480 + 320 = 800 г.
Определим массу вещества в исходном растворе:
m (соли) = 480*0.1 = 48 г
Найдем массовую долю соли в конечном растворе:
M = $m_{(соли)}$ / $m_к$ = 48/800 = 0.06 = 6%
Задача 13
Какую массу цинкового купороса $ZnSO_4 · 7H_2O$ необходимо добавить к 100 г раствора сульфата цинка с массовой долей 5 % для получения 10 %-ного раствора соли? (Запишите число с точностью до целых.) Ответ в (г).
Решение
Для начала найдем массу сульфата цинка в растворе:
100*0.05 = 5 г
Найдем массовую долю сульфата цинка в купоросе:
M($ZnSO_4$)/(7*M($H_2O$) + M($ZnSO_4$)) = 161/287 = 0.56
Примем массу купороса за m - тогда масса безводного сульфата цинка будет равна 0.56m
Составим уравнение:
5 + 0.56m = 0.1(m+100)
0.46m = 5
m = 5/0.46 = 10.87
Округлим до целых чисел – 11 грамм
Задача 14
К 200 г 10 %-ного раствора хлорида калия добавили 25 г этой же соли и 15 мл воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до сотых.) Ответ в (%).
Решение
Составим рисунок, схематически отображающий происходящие процессы.
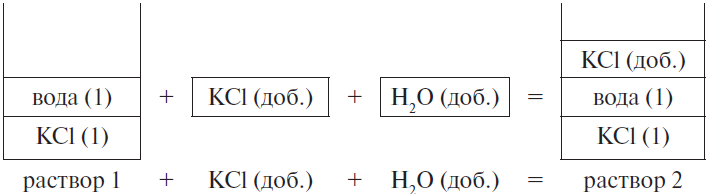
Массовая доля хлорида калия во 2-м растворе вычисляется по формуле:
$ω_2(KCl) = {m_2(KCl)}/{m_{р-ра2}}$,
где $m_2(KCl)$ — масса KCl во 2-м растворе, $m_{р-ра2}$ — масса 2-го раствора.
Очевидно, что:
1) масса хлорида калия равна сумме массы хлорида калия в первом растворе и массы добавленной соли, т. е.:
$m_2(KCl) = m_1(KCl) + m(KCl)_{доб.}$
Массу хлорида калия в 1-м растворе можно найти по формуле:
$m_1(KCl) = ω_1 · m_{р-ра 1}(KCl)$
2) масса второго раствора равна сумме масс первого раствора, добавленной соли и воды, т. е.:
$m_{р-ра 2} = m_{р-ра 1} + m(KCl)_{доб.} + m(H_2O)_{доб.}$
Проводим вычисления:
1) $m_1(KCl)$ = 0.1 · 200 = 20 г
2) $m_2(KCl)$ = 20 + 25 = 45 г
3) $m(H_2O)_{доб.}$ = 1 ∙ 15 = 15 г
4) $m_{р-ра 2}$ = 200 + 25 + 15 = 240 г
5) $ω_2(KCl)$ = 45 / 240 = 0.1875, или 18.75 %
Задача 15
200 мл 36,5 %-ного раствора соляной кислоты (плотностью 1,18 г/мл) оставили в открытой колбе в вытяжном шкафу, в результате концентрация кислоты снизилась до 30 %. Рассчитайте массу улетучившегося хлороводорода (испарением воды пренебречь). (Запишите число с точностью до сотых.) Ответ в (г).
Решение
Найдем массу начального раствора, умножив его объем на плотность:
m(раствор) = 200*1.18 = 236 г.
Найдем массу кислоты в растворе, умножив массу раствора на процентное содержание кислоты:
m(HCl, 1) = 236*0.365 = 86.14 г.
Найдем массу воды в растворе:
m($H_2O$) = 236 – 86.14 = 149.86 г.
Составим пропорцию:
149.86 – 70%
X – 30%
X – конечное количество кислоты
X = 64.23 г.
Найдем разницу масс кислоты:
∆m(HCl) = 86.14 – 64.23 = 21.91 г.
Задача 16
К раствору сульфида калия массой 60 г с массовой долей 4 % добавили 1,6 г этой же соли и выпарили 11,6 г воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до целых.) Ответ в (%).
Решение
ω = $m_{(комп.)}$ : $m_{(р-ра)}$
$m_{(комп.)}$ = $m_{(р-ра)}$ х ω
4% = 0.04
m($K_2S$) = 60 x 0.04 = 2.4 г
$m_{(р-ра)_2} = m_{(р-ра)_1}$ + 1.6 - 11.6
$m_{(р-ра)_2}$ = 50 г
ω($K_2S$) = (2.4 +1.6) : 50
ω($K_2S$) = 0.08 = 8%
Задача 17
Через 500 мл раствора с концентрацией аммиака 4 моль/л (ρ = 1,05 г/мл) пропустили 67,2 л (н. у.) аммиака. Рассчитайте массовую долю аммиака в полученном растворе. (Запишите число с точностью до десятых, %.)
Решение
n = CV, 500 мл = 0.5 л
$n(NH_3)_1$ = 4 · 0.5 = 2 моль
m = nM
$m(NH_3)_1$ = 2 · 17 = 34 г
n = V : Vm
n$(NH_3)_2$ = 67.2 : 22.4 = 3 моль
m$(NH_3)_2$ = 3 · 17 = 51 г
m$(NH_3)$ = m$(NH_3)_1$ + m$(NH_3)_2$ = 34 + 51 = 85 г
m = Vρ
m(р-ра1) = 500 · 1.05 = 525г
Массовая доля равна отношению массы компонента к массе раствора.
m(р-ра2) = m(р-ра1) + m$(NH_3)_1$ = 525 + 51 = 576г
Массовая доля $NH_3$ = 85 : 576 = 0.148 = 14.8 %
Задача 18
Какой объём (н. у.) бромоводорода необходимо растворить в 1 л воды для получения раствора с массовой долей 8,1 %? (Запишите число с точностью до десятых, л.)
Решение
Массовая доля – отношение массы вещества к массе раствора.
1 литр воды примерно равен килограмму.
Определим массу вещества в конечном растворе:
1 кг – 91.9 %
X – 8.1%
Решим пропорцию:
X = 0.088 кг = 88 г.
Определим количество моль бромоводорода:
m(HBr) = 88/81 = 1.09 моль
Определим объем HBr:
V(HBr) = 1.09·22.4 = 24.4 л
Задача 19
К 240 г раствора соли с массовой долей 10 % добавили 160 мл воды. Рассчитайте массовую долю соли в полученном растворе. (Запишите число с точностью до целых, %.)
Решение
Массовая доля – отношение массы вещества к массе раствора.
Определим массу вещества в исходном растворе:
m(в-во, исх.) = 240·10/100 = 24 г.
Определим массу конечного раствора:
m(р-р, кон.) = 160 + 240 = 400 г.
Определим массовую долю в конечном растворе:
w(кон.) = 24/400 = 0.06 = 6%
Задача 20
Рассчитайте массовую долю серной кислоты в растворе, полученном после выпаривания 20 г воды из 160 г её 5 %-ного раствора. (Запишите число с точностью до десятых, %.)
Решение
ω = $m_{(комп.)}$ : $m_{(р-ра)}$
$m_{(комп.)}$ = $m_{(р-ра)}$ х ω
5% = 0.05
m($H_2SO_4$) = 160 x 0.05 = 8 г
$m_{(р-ра)}_2$ = $m_{(р-ра)}_1$ - 20
$m_{(р-ра)}_2$ = 140 г
ω($H_2SO_4$) = 8 : 140 = 0.057 = 5.7%
Рекомендуемые курсы подготовки

- Разберешься с заданием №17 на классификацию реакций
- Научишься решать задание №18 на скорость реакции
- Познакомишься с химическим равновесием и научишься рассчитывать равновесные концентрации веществ
- Научишься решать задания №22 и №23
- Научишься решать задание №27 на тепловой эффект
на бесплатном курсе Турбо ЕГЭ

